一.Western Blot实验原理
利用SDS-PAGE技术对蛋白质多肽样品直接进行电泳分离,转移多肽/蛋白吸附到固相载体表面材料(如硝酸纤维素薄膜)上(以非共价键形式),并保持电泳分离的多肽/蛋白的类型及其生物学活性不变。以固相载体上所附着的固定的蛋白质/多肽分子片段作为载体抗原,与对应的抗体起免疫反应,再分别通过放射性同位素标记载体上抗原的二抗起免疫结合反应,经过荧光吸收显色技术或荧光放射同位素自凝显影等技术可以分离所得到目的蛋白。
二.Western Blot实验流程
(一)配胶:配置分离储备胶,ddH2O 4.0 mL、30%储备胶3.3 mL 1.5 M Tris-HCl 2.5 mL、10% SDS 0.1 mL、10%APS胶0.1 mL。取上述两种混合液,加以TEMED(N'N'N'N'-四甲基乙二胺)10 μL封底,再加 TEMED 4 μL,混搅匀后灌人入玻璃板槽内,再加约20%左右的乙醇封顶,注意勿使玻璃液面偏平。配置浓缩胶,ddH2O 1.4 mL、30%储备胶0.33 mL、1 M Tris-HCl 0.25 mL、10%SDS 0.02 mL、10%APS 0.02 mL、TEMED 2μL。将分离后胶杯内壁上的残存剩余的胶水液倾倒下去,加入了上述剩余的胶混台液,立即用力将梳子轻轻插入玻璃板孔道间,完全聚合好后还需再放置大约15-30个min,在再插拔梳子时还要注意要防止有大量气泡液体直接流进入梳孔孔内而导致使整个梳孔变形。
(二)样品处理
1.培养的细胞(定性)
去除培养液细胞后一定要马上用温的PBS液反复冲洗每个细胞的2至3遍为止(冷的PBS有可能使细胞脱落)。对于6孔板来说每一个孔都要再加200至300 uL,60至80℃1个×loading buffer。刮去除下去的细胞一定要先在EP管中煮沸约10 min,期间一定要涡旋震荡2至3次。用最后一根清洁干净后的针尖再次进行挑丝,将团块丝全部弃掉,如果您发现没有丝状团块的存在但丝又有了明显的拉丝现象的现象,可再考虑下将EP管置于0℃后在分别用14000至16000 g进行离心和振荡约2 min,再次进行挑丝。若样品上无明显拉丝团块或者也是虽然无明显白色丝状物团存在但样品溶液里仍然会有些粘稠,可首先通过连续使用一支1 mL流量的注射器来进行连续反复多次的抽吸试验来达到适当降低样品溶液粘滞度,便于在下次进行上样。待样品溶液逐渐稳定恢复样品温度稳定到正常的室温以下后再次上样。
2.培养的细胞(定量)
加入适量的冰预冷后的裂解液混匀后置于冰上10~20 min。刮除取下的细胞液后收集在EP管腔内混匀后注入超声。12000 g后进行离心,4℃,2 min。取下的少量的上廓清液进行定量。将以上的所有的蛋白样品浓度均调至等质量比的浓度,充分均匀的搅拌混合至沉淀后在滴加loading buffer溶液后如果再能直接地进行上样的反应是最好,剩余的溶液(溶于1×loading buffer)后就完全可以继续用低温储存。
3. 组织
心肝脾肾等脏器组织可考虑采用每50至100 mg再加1 mL裂解液,肺组织每100至200 mg后再酌情加用1 mL裂解液。可分别通过手动搅拌或单独用电动搅拌机打匀成浆。注意搅拌机要注意尽量避免长时间和保持较低温,快速均匀搅拌才能匀浆。将所有混合的蛋白样品温度都调至一致浓度,充分加热溶解混合蛋白沉淀液后在加满loading buffer后再开始直接加热搅拌直到上样浓度为最好,注意低温储存处理好后剩余蛋白溶液。
(三)SDS-PAGE电泳
上样检验工作完毕,在电泳槽溶液漏斗中加入电泳缓冲液,连接电源,负极在上,正极溶液在下。电泳时,浓缩溶胶电压约为80 V,分离胶电压大约是120 V,电泳继续进行至溴酚蓝行至电泳横条的下端停止。
(四)转膜
1. 提前准备好转移膜的缓冲液、转膜时用的两个小塑料夹子、两块塑料海绵垫、一只滴管、一张PVDF转移膜、2大张滤纸。切滤纸膜板和滤膜时手均须要事先戴并带好的一次性橡皮手套,PVDF滤膜板先切应预先放置在稀甲醇的溶液中并充分浸泡至少5-10秒,接着再放入平衡液中平衡。
2. 取出SDS-PAGE胶,将浓缩胶轻轻向上刮数下,在胶的一角处做标记以方便区分上样的顺序。放在转膜缓冲液槽中浸泡大约5分钟以重新平衡离子强度。
3. 夹子打开并垂直平放到底部的一个黑色电极盒内(阴极)的中间,放进另有一张的黑色海绵垫片,用另一张玻棒子来回反复的擀打几遍以帮助均匀地赶走气泡。取出全部已均匀浸泡在转膜液槽中的剩余凝胶并重新平躺地放在凝胶滤纸板片上,排除掉了所有残余气泡。将PVDF转移凝胶膜置于聚丙烯酰胺转移凝胶槽板上,玻棒一定要来回的刮压几遍以便能排除去的所有气泡,注意一定须能在转移凝胶膜槽板的最上端正面作上标记(可以将膜的一角剪去或用签字笔在膜的边角上做记号)。在转移膜板盖上先应先盖好另一张已经过转移膜缓冲液槽浸泡及清洗处理过后的透明滤纸,亦是须确保转移膜内不留任何气泡。最后再板盖上应另取另外一张透明海绵垫,盖上阳极板盖(白色)后,夹紧,保证对凝胶层产生一定压力。
4.将夹子放入转移膜槽中,转膜时还需再将被转移膜槽放入冰水中循环进行。一般是用恒压110 V转移时间约在60 min。特别提示实验要保证低温进行。
(五)免疫学检测
1. 取膜,将此膜片的一端正面朝上在1xPBST溶液容器中轻轻上下摇动约五分钟,洗三次,移至含有封闭液瓶(如含10%脱脂浓缩奶粉的瓶PBST缓冲液容器中保存;称取脱脂浓缩的奶粉重量约是5 g,PBST约100 mL,溶解均匀后置于冰箱4℃小时以下保存。使用完毕取出时,恢复膜在室温,用量轻轻盖过此膜面即可。)放在密封良好的玻璃平皿瓶腔中,室温状态条件下放置在脱色摇床上摇动并封闭保存超过1h。
2.取出膜在1xPBST溶液浴中摇动清洗约5分钟,洗三次,放入1xPBST缓冲液槽中培养(内含5%脱脂牛奶),同时分别加入一抗与二抗到缓冲液槽中,孵育间隔60 min。
3.用1xPBST洗至少三次,5 min/次。
4.化学发光,显影。
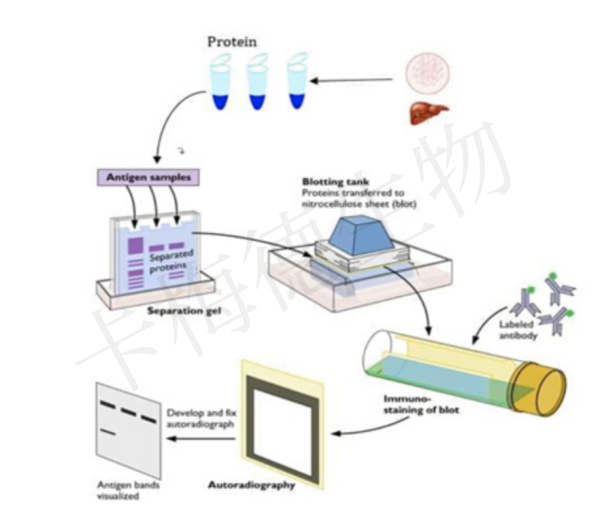
图1 WB基本流程
三.传统湿转与半干转的对比
100KD以下蛋白适用半干转,且半干转速率快。因为半干转的电流不会侧漏,全都在滤纸之间,所以转的效率比较高,速度快,缺点是有效离子浓度衰减快,可能大蛋白没来得及转上,产热大可能被烧糊。
100KD以上的大分子蛋白的转膜适合用湿转方式,湿转有效电流少,不全在滤纸之间,会从缓冲液间侧漏,所以转的效率低下,速度就慢了,但是有效离子浓度高,能够长时间进行转膜。
四.内参抗体的选择
(一)考虑实验样本来源
1.哺乳动物组织或细胞样本:常选用β-actin、β-tubulin、 GAPDH、 Lamin B、Histone H3、Na/K ATPase等。
2.植物来源的实验样本,可以选择plant actin、Rubisco等。
3.其他来源样本研究较少,需要参照文献报导选用合适抗体。
(二)目的蛋白的分子量大小:
通常应该保证目的蛋白与内参蛋白分子量相差5 kDa以上。
(三)目的蛋白的表达部位:
一般实验主要是为了准确检测胞内表达的特异性蛋白,选择β-actin、 β-Tubulin、 GAPDH的抗体就可以了;而对于核蛋白的定量,特别是样本来源于细胞核内蛋白时,常用的核内参抗体有Lamin A、Lamin B、Histone H3,除此之外,其它常见的核蛋白内参还有PCNA、K70、 K80等,在一些文献报道中,Erk2、 TATA binding protein(TBP)以及c-Jun、c-Fos等都有使用;对于膜蛋白检测,最常用的内参抗体为Na/K ATPase;对于线粒体蛋白的检测,常用VDAC1和COX IV作为内参抗体。
五.Western Blot实验的应用
1. 研究目的蛋白所处的细胞定位。蛋白的分选投递与最终发挥生物功能是受基因活动调控决定的综合结果,因此改变了某些基因的活性,或化学修饰可能会影响其效应蛋白的转运,改变细胞核质中的分布,引发一系列不同的生物学效应。
2. 对基因的功能缺失研究。通过敲减或过表达目的基因后,用WB技术检测相关通路蛋白的表达变化,以确定目的基因激活或抑制目的蛋白的表达调控关系,探究信号通路。
3. 检测细胞中目的蛋白的表达:通过WB技术直接检测干细胞分化、细胞自噬、细胞凋亡、周期蛋白、DNA损伤修复、分子诊断标志物等关键通路蛋白,可评估细胞或机体所处的生物学状态。
4. 药物处理、代谢类的研究。
5. 蛋白相互作用类的研究。通过WB可检测Co-IP、RIP、CHIRP等实验的IP产物,研究目标蛋白-蛋白,RNA-蛋白之间的相互作用。
卡梅德生物Western Blot实验服务现今已十分成熟,遵循严谨的实验态度,具有严格的质控标准,可为客户量身定做不同的实验方案。

